پروتئین ها
اسیدهای آمینه و ساختار آنها
پروتئین ها چیست؟
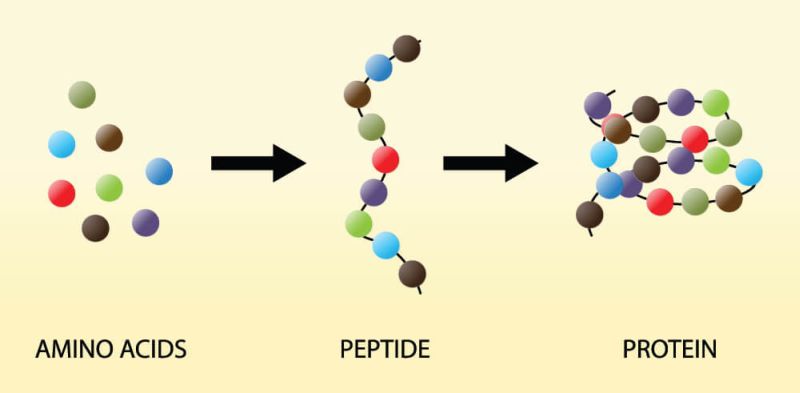
سنتز پپتیدها
تشکیل پیوند پپتیدی
تراکم
هیدرولیز
پلی پپتیدها چیست؟
ساختار پروتئین
1. ساختار اولیه
2. ساختار ثانویه
3. ساختار سوم
4. ساختار کواترنری
پیوند پروتئین
1. پیوندهای هیدروژنی
2. پیوندهای یونی
3. پیوندهای دی سولفیدی
فعل و انفعالات آبگریز و آب دوست
پروتئین های فیبری
1. کلاژن
2. کراتینه
3. الاستین
پروتئین های گلوبولار
1. هموگلوبین
2. انسولین
3. پپسین
پروتئین های مزدوج
1. گلیکوپروتئین ها
2. لیپوپروتئین ها
دناتوره شدن پروتئین
نقش و عملکرد پروتئین ها
اسیدهای آمینه و ساختار آنها
پروتئین ها درشت مولکول هایی هستند که از مونومرهایی به نام اسیدهای آمینه تشکیل شده اند. آمینو اسیدها واحد سازنده همه پروتئین ها هستند.
اسید آمینه یک ترکیب آلی ساده است که از یک گروه بازی (-NH2)، یک گروه اسیدی (-COOH) و یک گروه R آلی تشکیل شده است که برای هر اسید آمینه منحصر به فرد است.
واژه اسید آمینه کوتاه کلمه آلفا آمینو کربوکسیلیک اسید است. هر مولکول دارای یک اتم کربن مرکزی به نام α-کربن است که هر دو گروه به آن متصل هستند.
دو پیوند باقی مانده برای کربن مرکزی توسط اتم هیدروژن و یک گروه R آلی پر می شوند.
گروه R آلی می تواند به سادگی یک اتم هیدروژن (H) یا یک گروه متیل (-CH3) یا یک گروه پیچیده تر باشد.
بنابراین، کربن α در همه اسیدهای آمینه نامتقارن است به جز در گلیسین که در آن کربن α با یک اتم هیدروژن به عنوان یک گروه R متقارن است.
به دلیل این عدم تقارن، آمینو اسیدها (به جز گلیسین) به دو شکل فعال نوری وجود دارند: آنهایی که دارای گروه NH2 در سمت راست هستند به عنوان فرم D و آنهایی که دارای گروه NH2 در سمت چپ به عنوان فرم L هستند.
خاصیت وجود به دو شکل نوری متفاوت به عنوان کایرالیته نامیده می شود.
آمینو اسیدها ترکیباتی آمفوتریک با هر دو گروه اسیدی و قلیایی هستند. اینها نیز همیشه به صورت یون به جز در نقطه ایزوالکتریک وجود دارند.
فرمول کلی اسید آمینه به صورت زیر است:
R-CH(NH2)-COOH
پروتئین ها چیست؟
پروتئین ها ماکرومولکول های بسیار پیچیده ای هستند که از یک یا چند زنجیره بلند آمینواسید تشکیل شده اند که توسط پیوندهای پپتیدی به هم متصل شده اند.
پروتئین یک مولکول درشت مغذی است که در همه موجودات زنده وجود دارد و مستقیماً در مسیرهای متابولیک مختلف دخالت دارد. پروتئین ها برای گونه های خاص هستند و برای هر موجودی منحصر به فرد می باشند. همچنین پروتئین ها برای هر اندام اختصاصی هستند، چرا که پروتئینهای مغز با پروتئینهای ماهیچهها متفاوت است.
پروتئین ها از 20 اسید آمینه مختلف تشکیل شده اند و خاصیت یک مولکول پروتئین تابعی از اسیدهای آمینه موجود است. گیاهان قادر به سنتز تمام اسیدهای آمینه لازم برای ساخت پروتئین هستند، در حالی که حیوانات نمی توانند همه آنها را تولید کنند.
اسیدهای آمینه در پروتئین ها توسط پیوندهای پپتیدی که بین گروه NH2 یک اسید آمینه به گروه COOH یک اسید آمینه دیگر تشکیل می شود، به یکدیگر متصل می شوند. پروتئین ها نیز پلی پپتید نامیده می شوند، زیرا آنها زنجیره های بلندی از اسیدهای آمینه هستند که توسط پیوندهای پپتیدی به هم متصل می شوند.
سنتز پپتیدها
پپتید یک زنجیره کوتاه است که از اسید آمینه تشکیل شده است که همراه با سایر پپتیدها یک پروتئین را تشکیل می دهد.
زنجیره های پپتیدی زمانی تشکیل می شوند که دو یا چند اسید آمینه توسط پیوندهای پپتیدی به یکدیگر متصل شوند.
یک زنجیره پپتیدی می تواند به اندازه دو اسید آمینه داشته باشد. پپتیدهای بلندتر به نام پلی پپتید دارای پنجاه تا صد اسید آمینه هستند.
پپتیدها بر اساس تعداد اسیدهای آمینه موجود در پپتید به گروههای مختلفی دستهبندی میشوند. پپتیدهای دارای دو اسید آمینه دی پپتید نامیده می شوند در حالی که پپتیدهایی با بیش از ده اسید آمینه پلی پپتید نامیده می شوند.
پیوند پپتیدی تشکیل شده در پروتئین ها نوع خاصی از پیوند آمیدی است که بین دو مولکول وجود دارد که در آن یک گروه α-کربوکسیل از یک مولکول با گروه α-آمینه یک مولکول دیگر ترکیب می شود.
بنابراین زنجیره اسیدهای آمینه حاصل پپتید نامیده می شود.
تشکیل پیوند پپتیدی
یک پیوند پپتیدی بین دو مولکول اسید آمینه تشکیل می شود که در آن گروه α-کربوکسیل یک مولکول آمینو اسید با گروه α-آمینه یک مولکول مجاور واکنش می دهد و در نتیجه نوع خاصی از پیوند آمیدی ایجاد می شود.
تراکم
واکنش درگیر در تشکیل پیوند پپتیدی نمونه ای از واکنش تراکم است که منجر به کم آبی (حذف آب) می شود.
تشکیل پیوند پپتیدی زمانی آغاز می شود که گروه کربوکسیل یک اسید آمینه به سمت گروه آمین اسید آمینه دیگر حرکت می کند.
در طول فرآیند، یک گروه هیدروکسیل (OH) از گروه کربوکسیل (COOH) اولین اسید آمینه از بین می رود در حالی که، یک هیدروژن از گروه آمین (NH2) اسید آمینه دیگر از بین می رود.
بنابراین، یک مولکول آب (H2O) همراه با تشکیل یک پیوند آمیدی (C-N) بین دو اسید آمینه آزاد می شود.
تشکیل یک پیوند پپتیدی منفرد بین دو اسید آمینه باعث ایجاد یک مولکول دی پپتیدی می شود.
هیدرولیز
هیدرولیز پپتید یک فرآیند ضروری در برخی از واکنش های مصنوعی است که در آن اسیدهای آمینه در یک پپتید شکافته شده و به پپتید دیگر منتقل می شوند و در نتیجه یک زنجیره پپتیدی جداگانه سنتز می شود. هیدرولیز پیوند پپتیدی نیز یکی از مکانیسم های تخریب پیوند پپتیدی است. این شامل تقسیم پلی پپتیدها به پپتیدهای کوچکتر یا تجزیه پپتیدهای کوچکتر به مولکولهای اسید آمینه منفرد است.
هیدرولیز پیوند پپتیدی با حضور اسید کاتالیز می شود و شامل افزودن یک مولکول آب است.
در طول هیدرولیز، یک مولکول آب بین پیوند CO-NH در توالی پپتیدی وارد می شود. در نتیجه، دو اسید آمینه با گروه NH2 انتهایی در یک و گروه COOH در دیگری از هم جدا می شوند.
پلی پپتیدها چیست؟
- پلی پپتیدها زنجیره های بلندی از اسیدهای آمینه هستند که در آن بیش از ده اسید آمینه توسط پیوندهای پپتیدی به یکدیگر متصل شده اند.
- یک یا چند پلی پپتید متصل به هم پروتئین را تشکیل می دهند.
- یک سر یک پلی پپتید دارای یک گروه آمینه آزاد به نام ترمینال آمین یا ترمینال N است، در حالی که انتهای دیگر دارای یک گروه کربوکسیل آزاد به نام کربوکسیل ترمینال یا ترمینال C است.
- توالی اسیدهای آمینه در یک پلی پپتید توسط کدون های موجود در RNA پیام رسان که پلی پپتید از آن ترجمه می شود تعیین می شود.
- توالی کدون ها در mRNA به نوبه خود به توالی های نوکلئوتیدی در مولکول DNA وابسته است.
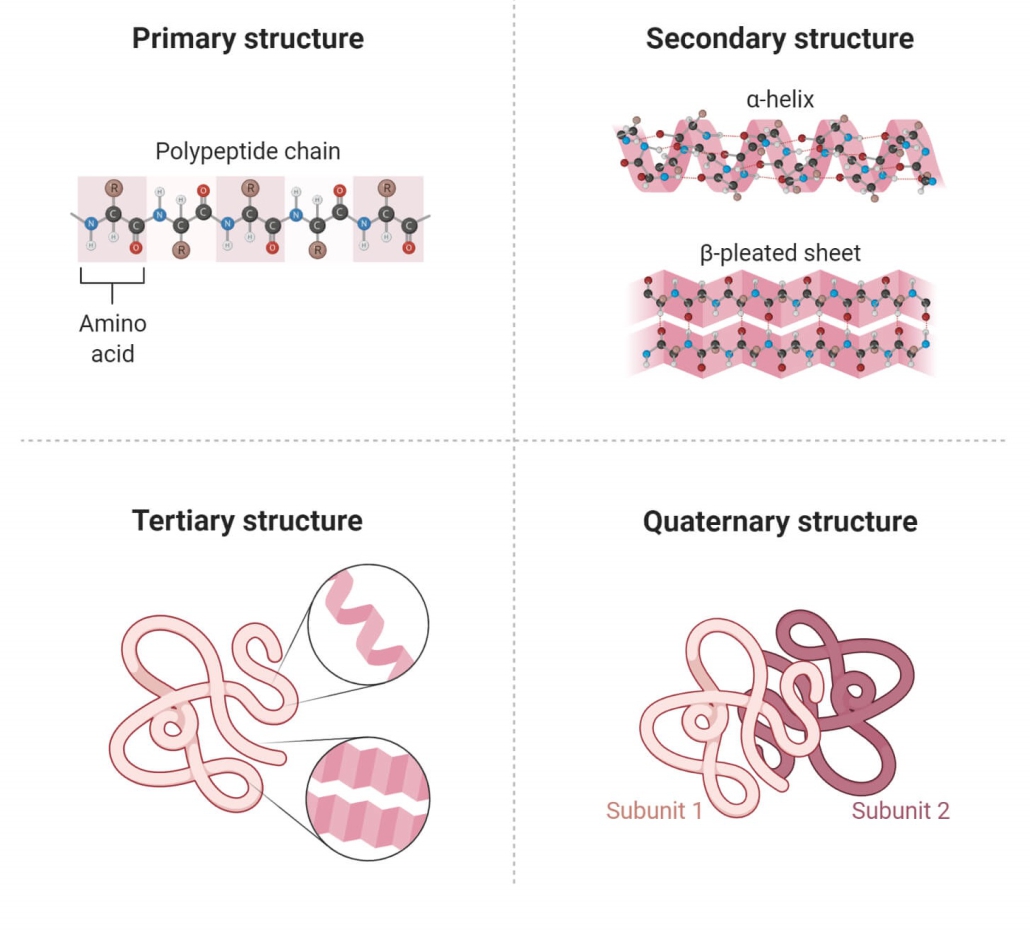
ساختار پروتئین
از آنجایی که پروتئین یک ماکرومولکول پیچیده است، ساختار آن با استفاده از چهار سطح ساختاری اساسی سازمان توصیف شده است.
این سطوح ساختاری اغلب به عنوان اولیه، ثانویه، سوم و چهارم نامیده می شوند.
سه مورد از این سطوح ساختاری (اولیه، ثانویه و سوم) میتوانند در مولکولهای متشکل از یک زنجیره پلی پپتیدی منفرد وجود داشته باشند. در مقابل، ساختار چهارم شامل برهمکنش پلی پپتیدها در یک مولکول پروتئین چند زنجیره ای است.
ساختار اولیه
ساختار اولیه یک پروتئین به عنوان دنباله ای از اسیدهای آمینه به هم متصل شده و یک زنجیره پلی پپتیدی تشکیل می شود. هر اسید آمینه از طریق پیوندهای پپتیدی ایجاد شده در طی فرآیند بیوسنتز پروتئین به اسید آمینه بعدی متصل می شود. دو انتهای هر زنجیره پلی پپتیدی به عنوان پایانه آمین (N-terminus) و انتهای کربوکسیل (C-terminus) شناخته می شوند. بیست اسید آمینه مختلف را می توان چندین بار در یک پلی پپتید برای ایجاد یک توالی ساختار پروتئین اولیه خاص استفاده کرد.
ساختار اولیه پروتئین ها ترتیب دقیق اسیدهای آمینه است که زنجیره آنها را تشکیل می دهند. توالی دقیق پروتئین ها بسیار مهم است زیرا چین خوردگی نهایی و در نتیجه عملکرد پروتئین را تعیین می کند. تعداد زنجیره های پلی پپتیدی با هم پروتئین ها را تشکیل می دهند.
ساختار ثانویه
ساختار اولیه خطی و بازشده زنجیره پلی پپتیدی اغلب یک شکل مارپیچ برای تولید ساختار ثانویه به خود می گیرد. ساختار ثانویه پروتئین ها به رابطه فضایی یا فضایی اسیدهای آمینه نزدیک به یکدیگر در توالی اسید آمینه اشاره دارد. چین خوردگی زنجیره عمدتاً به دلیل وجود پیوندهای هیدروژنی است که می تواند درون مولکولی یا بین مولکولی باشد.
تاخوردگی و پیوند هیدروژنی بین اسیدهای آمینه همسایه منجر به تشکیل ساختاری صلب و لولهای به نام مارپیچ میشود. ساختارهای ثانویه در پروتئین ها بر اساس ماهیت پیوند هیدروژنی دو نوع هستند. آلفا هلیکس (α-helix) و صفحات بتا (β-sheet).
آ. ساختار آلفا مارپیچ
ساختار آلفا مارپیچ زمانی تشکیل می شود که گروه CO هر اسید آمینه با پیوند هیدروژنی به گروه NH اسید آمینه که چهار باقیمانده جلوتر در توالی خطی وجود دارد، متصل شود.
ساختار α-مارپیچ به پیوند هیدروژنی درون مولکولی بین گروه های NH و CO پیوندهای پپتیدی بستگی دارد.
ب. صفحات بتا
ساختار صفحات بتا از هم ترازی موازی تعدادی زنجیره پلی پپتیدی، با پیوندهای هیدروژنی بین گروه های C=O و N-H زنجیره های مجاور تشکیل می شود.
گروه های R آمینو اسیدهای تشکیل دهنده در یک زنجیره پلی پپتیدی به طور متناوب در بالا و زیر صفحه ورق قرار می گیرند.
تشکیل صفحات بتا به پیوند هیدروژنی بین مولکولی بستگی دارد، اگرچه پیوندهای هیدروژنی درون مولکولی نیز وجود دارد.
ج. ساختار سوم
ساختار سوم مولکول پروتئین یک ساختار سه بعدی از پروتئین است که از تا شدن ساختار ثانویه در الگوهای خاصی تشکیل شده است.
ساختار سوم عموماً توسط برهمکنشهای هیدروژن آبدوست و پیوند یونی خارجی قطبی و برهمکنشهای آبگریز داخلی بین زنجیرههای جانبی اسید آمینه غیرقطبی تثبیت میشود. بر اساس ساختار سوم، پروتئین ها اغلب به انواع کروی یا فیبری تقسیم می شوند.
a. پروتئین های فیبری
پروتئین های فیبری ساختارهای طناب مانند درازی دارند که قوی و آبگریز هستند و معمولاً عمدتاً از یک نوع ساختار ثانویه تشکیل شده اند.
ساختارهایی که حمایت، شکل و محافظت خارجی را برای مهره داران فراهم می کنند از پروتئین های فیبری مانند α-کراتین ساخته شده اند.
b. پروتئین های کروی
پروتئین های کروی اغلب حاوی چندین نوع ساختار ثانویه هستند و بیشتر کروی و آبدوست هستند.
بنابراین، بیشتر آنزیم ها و پروتئین های تنظیم کننده مانند ایمونوگلوبولین ها پروتئین های کروی هستند.
د. ساختار کواترنری
ساختار کواترنر یک ویژگی پروتئینی مهم است که ارتباط نزدیکی با عملکرد آن دارد. پروتئین هایی که ساختار چهارتایی دارند، پروتئین های الیگومری نامیده می شوند. پروتئین های الیگومر در فرآیندهای بیولوژیکی مختلفی مانند متابولیسم، انتقال سیگنال و همانندسازی کروموزوم نقش دارند.
پیوند پروتئین
علاوه بر پیوندهای پپتیدی اولیه، چندین پیوند ثانویه دیگر مسئول تشکیل ساختار خالص پروتئین ها هستند.
برخی از پیوندهای ثانویه رایج موجود در پروتئین ها عبارتند از:
1- پیوند هیدروژنی
پیوند هیدروژنی در پروتئین ها به دلیل تمایل یک اتم هیدروژن که به طور کووالانسی به یک اتم الکترونگاتیو پیوند دارد برای به اشتراک گذاشتن الکترون ها با اتم های مجاور مانند O یا N تشکیل می شود.
در یک پیوند پپتیدی، پیوند هیدروژنی را می توان به صورت زیر مشاهده کرد:
-C=O∙∙∙∙∙∙∙∙∙∙∙∙HN-
خط نقطه چین بین اتم های اکسیژن و هیدروژن در پیوند پپتیدی نشان دهنده یک پیوند هیدروژنی است.
پیوند هیدروژنی در پروتئین مهم است زیرا ساختار ثانویه پروتئین ها را تثبیت می کند.
2. پیوندهای یونی
پیوندهای یونی در پروتئین ها بین گروه های اسیدی و بازی اسیدهای آمینه تشکیل دهنده مشاهده می شود.
فعل و انفعالات الکترواستاتیکی نیز بین گروه های دارای بار متفاوت موجود در زنجیره های جانبی اسیدهای آمینه وجود دارد.
گروه های یونیزه به جای تثبیت ساختار پروتئین در تثبیت فعل و انفعالات بین پروتئین و سایر مولکول ها نقش دارند.
این پیوندهای یونی، اگرچه ضعیف تر از پیوندهای هیدروژنی هستند، اما مسئول حفظ ساختار سه بعدی یا ساختار سوم پروتئین های کروی هستند.
3. پیوندهای دی سولفیدی
پیوند دی سولفیدی دومین نوع پیوند کووالانسی است که بین بقایای اسید آمینه در پروتئین ها و پلی پپتیدها یافت می شود.
این پیوند با اکسیداسیون گروه های تیول یا سولفیدریل (-SH) از دو باقی مانده سیستئین برای تولید سیستئین ایجاد می شود.
حتی اگر پل های دی سولفیدی در مقایسه با استحکام پیوندهای غیرکووالانسی بسیار قوی باشند، آنها برد کوتاهی دارند و تنها زمانی که پیوند کاملاً تشکیل شد می توانند ساختار سوم را تثبیت کنند.
فعل و انفعالات آبگریز و آب دوست
فعل و انفعالات آبگریز بین زنجیره های جانبی یا گروه های R اساساً آبگریز رخ می دهد. گروه های آبگریز در بین خود متحد می شوند و باعث می شوند که آب از بین برود و پیوندهایی بین بخش های مختلف یک زنجیره یا بین زنجیره های مختلف ایجاد کند.
فعل و انفعالات آبگریز همچنین ممکن است به پیوندهای دیگری مانند پیوندهای هیدروژنی یا پیوندهای یونی بین گروه های دیگر منجر شود. پیوندهای آبگریز همچنین به سایر فعل و انفعالات پروتئینی کمک می کنند، به عنوان مثال، تشکیل کمپلکس های آنزیم- سوبسترا و برهمکنش های آنتی بادی-آنتی ژن.
فعل و انفعالات آبدوست منجر به پیوند هیدروژنی بین اتم های الکترونگاتیو و اتم های هیدروژن می شود.
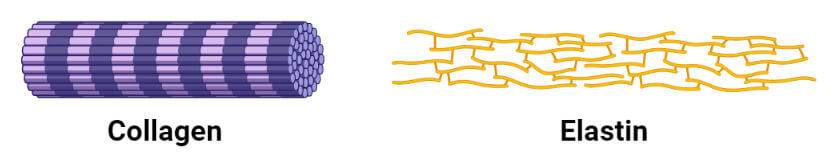
پروتئین های فیبری
- کلاژن
- کراتین
- الاستین
1. کلاژن
کلاژن فراوان ترین پروتئین پستانداران است که حدود 25 تا 33 درصد از کل پروتئین های بدن را تشکیل می دهد. این عنصر ساختاری اصلی بدن انسان است که در بافت های همبند مانند تاندون ها، غضروف ها، ماتریکس آلی استخوان ها و قرنیه چشم یافت می شود.
از نظر ساختاری، مارپیچ کلاژن یک ساختار ثانویه منحصر به فرد است که کاملاً از مارپیچ α متمایز است. چپ دست است و در هر نوبت سه باقی مانده اسید آمینه وجود دارد.
کلاژن نیز یک سیم پیچ پیچ خورده است، اما با ساختارهای سوم و چهارم مشخص که در آن سه پلی پپتید مجزا به نام زنجیره α در اطراف یکدیگر پیچیده شده اند. به طور معمول آنها حاوی حدود 35٪ گلیسین، 11٪ آلانین، و 21٪ پرولین و 4-هیدروکسی پرولین هستند.
2. کراتین
کراتین یا α-کراتین یک پروتئین فیبری است که تقریباً کل وزن خشک مو، پشم، ناخن، پنجه، شاخ، سم و بیشتر لایه بیرونی پوست پستانداران را تشکیل میدهد.
α-کراتین ها بخشی از خانواده وسیع تری از پروتئین ها به نام پروتئین های رشته میانی (IF) هستند.
مارپیچ α-کراتین یک مارپیچ α راست دست است، ساختار ثانویه ای که در بسیاری از پروتئین های دیگر یافت می شود.
دو رشته α-کراتین که به صورت موازی قرار گرفته اند، در اطراف یکدیگر پیچیده شده اند تا یک سیم پیچ فوق العاده پیچ خورده را تشکیل دهند که استحکام ساختار کلی را تقویت می کند.
یک پلی پپتید مجزا در سیم پیچ آلفا-کراتین دارای ساختار سوم نسبتاً ساده است که توسط یک ساختار ثانویه α-مارپیچ با محور مارپیچ آن که در یک ابرمارپیچ چپ گرد پیچ خورده است، غالب است.
درهم تنیدگی دو پلی پپتید α-مارپیچ در کراتین به عنوان نمونه ای از ساختار چهارتایی عمل می کند.
3. الاستین
الاستین یک پروتئین اصلی است که در اندام های مختلفی یافت می شود که به خاصیت ارتجاعی نیاز دارند مانند: ریه ها، مثانه و غضروف های الاستیک
زنجیره پلی پپتیدی از پروتئین تروپوالاستین، حاوی گلیسین و والین و آلانین و پرولین اصلاح شده تشکیل شده است. به دلیل عملکرد ساختاری و نامحلول بودن در آب به عنوان پروتئین فیبری طبقه بندی می شود.
الاستین فاقد ساختار ثانویه منظم است و دارای پیوندهای متقابل توالی های مختلف پروتئین است. الاستین همچنین غنی از گلیسین و پرولین است، اما مولکول گلیسین مانند هر باقی مانده سوم در کلاژن ندارد.
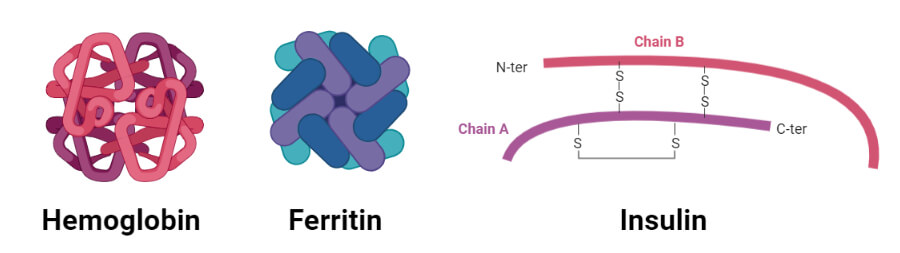
پروتئین های گلوبولار
- هموگلوبین
- انسولین
- پپسین
1. هموگلوبین
- هموگلوبین ناقل اکسیژن در گلبول های قرمز است و حدود 90 درصد پروتئین گلبول های قرمز را تشکیل می دهد.
- این یک پروتئین تترامری با چهار زنجیره پلی پپتیدی است که توسط فعل و انفعالات غیرکووالانسی به هم متصل می شوند.
- دو تا از چهار زنجیره پلی پپتیدی زنجیره α هستند و دو زنجیره باقی مانده زنجیره β هستند.
- زنجیره های α و β هموگلوبین حاوی چندین بخش از مارپیچ α هستند که به صورت یک جفت توسط پیوندهای یونی و هیدروژنی کنار هم قرار گرفته اند.
- به طور مشابه، چهار زنجیره پلی پپتیدی تقریباً به صورت چهار وجهی با هم قرار می گیرند تا ساختار چهارتایی مشخصه را ایجاد کنند.
2. انسولین
- انسولین یک هورمون پپتیدی است که توسط سلول های بتا پانکراس تولید می شود و متابولیسم کربوهیدرات ها، چربی ها و پروتئین ها را تنظیم می کند.
- انسولین تولید شده در بدن به شکل هگزامر ذخیره می شود، اما شکل فعال آن یک مونومر است.
- هگزامر به عنوان راهی برای پایدار نگه داشتن پروتئین و محافظت از آن عمل می کند.
- یک تک مونومر پروتئینی انسولین از 51 اسید آمینه تشکیل شده است که توسط دو زنجیره پپتیدی که توسط پیوندهای دی سولفیدی به هم مرتبط شده اند تشکیل شده است.
- یکی از زنجیره ها دارای دو مارپیچ α است در حالی که زنجیره های دیگر دارای یک مارپیچ α و دو ورق β هستند.
- توالی اسیدهای آمینه در انسولین به شدت حفظ شده است و بین گونه های مختلف فقط کمی متفاوت است.
3. پپسین
- پپسین آنزیمی است که پروتئین ها را به پپتیدها یا اسیدهای آمینه کوچکتر تجزیه می کند.
- این یکی از سه پروتئاز مهم در بدن انسان به همراه تریپسین و کیموتریپسین است.
- پپسین توسط سلول های دیواره معده به شکل پپسینوژن آزاد می شود که پس از مخلوط شدن با اسید هیدروکلریک به پپسین تبدیل می شود.
- ساختار ثانویه غالب در پپسین صفحات β به همراه شش مارپیچ α راست دست است.
- پپسین همچنین بخشی از مایه پنیر است که برای بستن شیر در هنگام تولید پنیر استفاده می شود.
پروتئین های مزدوج
- گلیکوپروتئین ها
- لیپوپروتئین ها
1. گلیکوپروتئین ها
گلیکوپروتئین ها پروتئین های حاوی کربوهیدرات به عنوان یک گروه مصنوعی هستند. آنها حاوی مقادیر کمی کربوهیدرات (معمولا کمتر از 4٪) هستند. گلیکوپروتئین ها به عنوان پروتئین های جدایی ناپذیر مهم در غشاهای بیولوژیکی مختلف عمل می کنند که به تعاملات سلول-سلول کمک می کنند.
ایمونوگلوبولین ها گلیکوپروتئین های مهم سیستم ایمنی هستند که به عنوان آنتی بادی عمل می کنند و در برابر آنتی ژن ها محافظت می کنند. به طور مشابه، گلیکوپروتئین های محلول نیز در آلبومین تخم مرغ و پلاسمای خون یافت می شوند.
2. لیپوپروتئین ها
لیپوپروتئین ها پروتئین هایی هستند که با لیپیدهایی مانند سفالین، لسیتین و کلسترول کمپلکس تشکیل می دهند. اینها در آب محلول هستند اما در حلالهای آلی نامحلول هستند.
لیپوپروتئین ها به عنوان واسطه های موقت در فرآیند انتقال لیپیدها از محل جذب به محل استفاده عمل می کنند.
دناتوره شدن پروتئین
دناتوره شدن پروتئین فرآیند تخریب ساختارهای چهارم، سوم و ثانویه پروتئین ها با اعمال نیروی خارجی یا مواد شیمیایی قوی مانند اسید و باز است.
دناتوره شدن پروتئین ممکن است فعالیت سلولی را از بین ببرد زیرا بسیاری از مسیرهای متابولیک به پروتئین در یک شکل یا شکل دیگر نیاز دارند.
پس از دناتوره شدن، پروتئین ها طیف وسیعی از خواص مانند تغییر ساختار و از دست دادن حلالیت را نشان می دهند.
پیوندهای هیدروژنی مسئول ساختار سوم پروتئین ها ضعیف هستند و به راحتی با گرما و تشعشع می شکنند.
با این حال، دناتوراسیون بر ساختار اولیه پروتئین ها تأثیر نمی گذارد.
در برخی موارد، دناتورهسازی برگشتپذیر است و پروتئینها میتوانند پس از حذف عامل استرس، شکل اصلی خود را به دست آورند. با این حال، برخی از موارد دناتوره شدن غیر قابل برگشت هستند.
نقش و عملکرد پروتئین ها
پروتئین ها مولکول های زیستی ضروری هستند که برای زندگی و انجام فعالیت های مختلف حیاتی هستند. برخی از نقش های بیولوژیکی مهم پروتئین ها عبارتند از:
بسیاری از پروتئین ها به عنوان کاتالیزور عمل می کنند که سرعت واکنش های شیمیایی را در مسیرهای متابولیکی مختلف افزایش می دهد.
پروتئینهای فیبری جزئی از بافتهای مختلف هستند که عناصر اسکلتی را مانند کلاژن، که یک واحد ساختاری از بافتهای همبند است، در کنار هم نگه میدارند.
نوکلئوپروتئین ها به عنوان حامل ویژگی های ژنتیکی عمل می کنند و از این رو بر وراثت صفات حکومت می کنند.
پروتئین ها همچنین عملکردهای انتقالی را انجام می دهند که حمل و نقل بسیاری از ترکیبات را به داخل و خارج سلول ها تنظیم می کند.
هورمون های پروتئینی مختلف علاوه بر کنترل بسیاری از عملکردهای فیزیولوژیکی دیگر، رشد گیاهان و حیوانات را تنظیم می کنند.
پلاسمای خون دارای پروتئین های محلول متعددی است که می توان از آنها برای درمان شوک ناشی از جراحات و عمل های شدید استفاده کرد.
اینترفرون ها گلیکوپروتئین های تنظیمی هستند که توسط بسیاری از سلول های یوکاریوتی در پاسخ به عفونت ویروسی، اندوتوکسین ها، محرک های آنتی ژنی و بسیاری از ارگانیسم های انگلی تولید می شوند.
پپتیدهای انسان به نام دفنسین ماهیت آنتی بیوتیکی دارند.
“کیمیا زیست گستر نوین” در راستای ارتقاء تولیدات و سطح علمی کشور مبادرت به واردات و توزیع مواد شیمیایی و مصرفی آزمایشگاهی کرده است. هدف مجموعه ما تأمين مواد و تجهيزات مورد نياز در بخش هاى مختلف آزمايشگاهى، تحقيقاتى، بيمارستانى، صنعتى و … مي باشد.